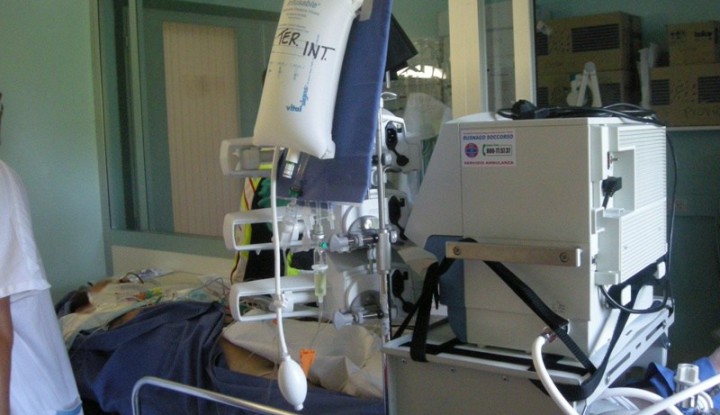
Rimozione Extracorporea dell’anidride carbonica con il sistema ILA Membreane Ventilator: quale ruolo nel Trasporto Secondario
Pubblicato su N&A n. 201 di luglio 2009
 Autori
Autori
Federico Emiliano Ghio (Infermiere – Busnago Soccorso)
Maurizio Monfredini (Infermiere – Ospedale “Fornaroli” di Magenta)
Fabio Salvatore Lionti (Medico – Busnago Soccorso)
Carlo Serini (Medico – Ospedale Fatebenefratelli di Milano)
Simona Magni (Medico – Ospedale di Vimercate)
Simone Della Torre (Istruttore Regionale 118 – Busnago Soccorso)
Marco Gramuglio (Istruttore Regionale 118 – Busnago Soccorso)
Introduzione
 Negli ultimi anni, il trattamento dell’Acute Respiratory Distress Sindrome (ARDS) ha subito numerose evoluzioni a partire dai concetti espressi da Gattinoni e Kolobow nel 1977 (Tabella 1). L’utilizzo dell’ECMO (Extracorporeal Membrane Oxygenation) e di altre metodiche alternative come la pronazione, l’utilizzo di ossido nitrico, la ventilazione liquida, la somministrazione di prostacicline e la ventilazione ad alta frequenza hanno ormai affiancato la tradizionale ventilazione meccanica, benché alcune di queste tecniche (in particolare l’ECMO) possano e debbano essere istituite solo in centri specialistici. Negli Stati Uniti, l’incidenza di ARDS (Acute Respiratory Distress Syndrome) è di circa 190.000 casi/anno, con una mortalità del 52-66%.
Negli ultimi anni, il trattamento dell’Acute Respiratory Distress Sindrome (ARDS) ha subito numerose evoluzioni a partire dai concetti espressi da Gattinoni e Kolobow nel 1977 (Tabella 1). L’utilizzo dell’ECMO (Extracorporeal Membrane Oxygenation) e di altre metodiche alternative come la pronazione, l’utilizzo di ossido nitrico, la ventilazione liquida, la somministrazione di prostacicline e la ventilazione ad alta frequenza hanno ormai affiancato la tradizionale ventilazione meccanica, benché alcune di queste tecniche (in particolare l’ECMO) possano e debbano essere istituite solo in centri specialistici. Negli Stati Uniti, l’incidenza di ARDS (Acute Respiratory Distress Syndrome) è di circa 190.000 casi/anno, con una mortalità del 52-66%.
Oltre all’ARDS vera e propria, altre patologie respiratorie ed extrapolmonari possono richiedere il ricorso a strategie terapeutiche particolarmente avanzate (ECMO, iLA Membrane Ventilation, HFO) che da alcuni anni possono essere utilizzate anche in regime di urgenza. Il trasferimento di soggetti con grave compromissione polmonare da una struttura periferica ad un centro specializzato, rappresenta un aspetto critico nella cura di questi pazienti: è infatti noto che il momento del trasporto è associato allo scadimento degli scambi respiratori, all’acidosi ed all’aumento della mortalità.
Criteri diagnostici per l’ARDS
Questa sindrome ha ricevuto negli anni diverse definizioni: polmone umido, polmone da shock, edema polmonare da lesione capillare. Tra le diverse denominazioni, si è imposto negli anni il termine “Acute Respiratory Distress Syndrome”. Tale patologia colpisce sia pazienti pediatrici che in età adulta.
Nella classificazione proposta dall’American European Consensus Conferente on ARDS nel duemila, la diagnosi viene posta secondo i seguenti criteri:
- Insorgenza acuta
- PaO2/FiO2 < 200 indipendentemente da livello di PEEP
- Infiltrati polmonari bilaterali (dopo 12-24 ore)
- Compliance < 30 ml/cm H2O
- PCWP < 18 mmHg
- Evocata da “evento catastrofico” (trauma, chirurgia, ect.)
L’ARDS non rappresenta una malattia a primitivismo polmonare, ma una complicanza che ha luogo quando altri stati patologici generano una forma severa e progressiva di risposta infiammatoria sistemica. Il processo infiammatorio coinvolge i polmoni, condizionando l’accumulo -fino all’obliterazione- di eritrociti, leucociti e frammenti proteinacei all’interno degli spazi aerei alveolari. Si ritiene che il consolidamento polmonare sia determinato da un’attivazione sistemica dei neutrofili circolanti: questi aderiscono all’endotelio vascolare nei capillari polmonari e rilasciano poi il contenuto dei loro granuli citoplasmatici (enzimi proteolitici e metaboliti tossici dell’ossigeno) causando danno endoteliale con conseguente essudazione di natura lesionale all’interno dei capillari del parenchima polmonare. I neutrofili ed altri mediatori dell’infiammazione possono quindi accedere al parenchima polmonare e proseguire il processo infiammatorio.
Il quadro clinico dell’ARDS è caratterizzato da una grave condizione di infiammazione polmonare, condizionante ipossiemia nonostante l’utilizzo di elevate percentuali di FiO2. A ciò si associa un’alterazione del rapporto ventilazione/perfusione secondario ad uno shunt polmonare destro-sinistro. La diminuzione della compliance polmonare è dovuta all’accumulo di fluidi extravascolari.
L’ipercapnia e l’ipertensione polmonare complicano spesso sia l’ARDS che l’ALI. I fattori predisponenti allo sviluppo di ARDS sono rappresentati da politrauma, sepsi, ab-ingestis, ustioni, polmoniti, intossicazioni. La diagnosi differenziale viene posta con l’edema polmonare cardiogeno (pressione di incuneamento polmonare > 18 mmHg) e l’Acute Lung Injury (ALI).
Per quanto attiene la diagnosi di ALI – Acute Lung Injury, la stessa viene posta in presenza di:
- Insorgenza acuta
- PaO2/FiO2 < 300
- Infiltrati polmonari bilaterali (dopo 12-24 ore)
- Compliance < 30 ml/cm H2O
- PCWP < 18 mmHg
- Evocata da “evento catastrofico” (trauma, chirurgia, ecc.).
Il trasporto del paziente con ALI/ARDS
I semplici ventilatori volumetrici, normalmente impiegati sui mezzi di soccorso, non sono in grado di garantire una gestione sicura dei soggetti affetti da ALI/ARDS. Senza dubbio, la possibilità di disporre di un ventilatore da terapia intensiva, a bordo dell’Unità Mobile di Rianimazione o dell’eliambulanza, rappresenta il gold-standard per il trattamento di questi pazienti. Il limite di tali strumenti è rappresentato dalle loro dimensioni e dall’impossibilità, nella maggior parte dei casi, di disporre di carrelli e/o sistemi di ritenuta omologati che mettano al riparo l’operatore non solo da problematiche di tipo clinico logistico ma anche di natura medico-legale. Occorre del resto sottolineare che durante il trasporto non possono essere adottate tecniche speciali come la pronazione e la ventilazione con ossido nitrico.
Il cambio del ventilatore rappresenta uno dei momenti più difficili del trasporto: la possibilità che il paziente si disadatti, la perdita della PEEP e la diversa risposta del ventilatore al paziente, anche a parità di strategia ventilatoria, esitano spesso nel deterioramento degli scambi respiratori ed in un aumentato rischio di complicanze e mortalità. Secondo Villa et al. nel testo “Tecniche di ventilazione artificiale” è prevista la possibilità di connettere il paziente al ventilatore, utilizzato per un tempo ragionevole prima dell’inizio del trasferimento, verificando con emogasanalisi seriate ed esami radiografici l’efficacia della terapia impostata. Tuttavia, spesso, tale approccio non viene o non può essere adottato, con la conseguente predisposizione ad eventi avversi durante il viaggio.
La mancata disponibilità di ventilatori da terapia intensiva impone di accettare un mediocre controllo degli scambi adottando modalità ventilatorie che si configurano ben al di fuori del concetto di ventilazione protettiva, introdotto da Amato et al. nel 1998; non solo, spesso, tale approccio fallisce, generando l’aggravarsi delle condizioni cliniche.
In ultimo, è stato dimostrato come il trasporto di questi pazienti da parte di personale non specificamente addestrato si traduca in un outcome sfavorevole.
L’intervento di un equipe specialistica in grado di avviare l’ECMO o la pECLA al luogo di partenza, dovrebbe essere presa in considerazione quando l’approccio standard fallisce ed il paziente versa in condizioni di grave instabilità cardiorespiratoria.
L’assistenza clinica durante il trasporto deve essere assicurata tramite una corretta dotazione strumentale ed un equipe specificatamente addestrata alla gestione di questi pazienti.
Per quanto concerne l’aspetto ventilatorio, giova ricordare che la perdita della PEEP può essere evitata serrando il tubo con una pinza retta mentre il paziente viene connesso al ventilatore da trasporto. Un sistema di aspirazione delle secrezioni a circuito chiuso impedirà ulteriori perdite di pressione. Il problema dell’auto-trigger è frequente quando vengono utilizzate modalità di ventilazione assistite (BIPAP) con valori di trigger a flusso particolarmente bassi (da 1 a 3 l/min). L’attivazione automatica del trigger è generalmente dovuta all’oscillazione del circuito ventilatorio, meno frequente alle vibrazioni prodotte dall’elicottero o da un ambulanza su fondo stradale in buone condizioni. Rendere il circuito stabile (evitando di sospenderlo tra paziente e ventilatore e facendolo decorrere a lato del paziente o sul torace dello stesso) consentono l’utilizzo di un trigger adeguato al paziente senza complicazioni: quando tale provvedimento non risulta sufficiente, è possibile innalzare la soglia del trigger di 1 l/min e verificare il risultato. Il circuito del ventilatore deve essere sterile per prevenire l’insorgenza di VAP (Ventilator Associated Pneumoniae).
Il monitoraggio deve comprendere: ECG, pressione arteriosa cruenta, pressione arteriosa non cruenta (da utilizzare come back-up), EtCO2, SpO2%. In caso sia presente un catetere di Swan-Ganz, questo deve essere retratto in prossimità dell’atrio destro, istituito il monitoraggio dell’onda e opportunamente fissato per impedirne la dislocazione durante il trasporto. La temperatura vescicale o esofagea deve essere monitorizzata in continuo, specialmente quando vengono intraprese metodiche di ossigenazione/rimozione CO2 extracorporee. Gli accessi vascolari per l’ECMO o l’iLA devono essere prontamente accessibili: durante l’utilizzo dell’iLA deve essere prevista la presenza di due pinze rette in materiale plastico per clampare il sistema in caso di arresto cardiaco o grave ipotensione.
Il presidio più indicato per il trasporto sembra essere il materasso a depressione, che garantisce miglior confort al paziente e l’assorbimento delle vibrazioni. La possibilità di ottenere dati emogasanalitici durante il trasporto deve essere considerata per pazienti particolarmente compromessi o per viaggi di durata superiore alla mezz’ora. Un centro mobile di rianimazione di back-up deve seguire la prima ambulanza quando si attende al trasporto di pazienti particolarmente instabili. Invariate le già note raccomandazioni in termini di disponibilità di alimentazione elettrica, batterie di scorta, gas medicali.
Centralizzazione
I pazienti con ALI/ARDS, che non rispondono alla terapia standard, dovrebbero essere avviati a centri ad alta specializzazione in grado di istituire terapie come l’ossigenazione extracorporea. Al momento, in Italia, non esiste un network relativo alla gestione dei pazienti affetti da ARDS/ALI refrattaria, con il risultato che la centralizzazione non avviene seguendo criteri specifici, con conseguente ritardo ed outcome sfavorevole. Da questo punto di vista appare particolarmente interessante il progetto “Codice Viola”, avviato dal Policlinico San Matteo di Pavia: in questo sistema, non solo sono stati posti e diffusi agli ospedali della zona parametri di attivazione di un’equipe in grado di eseguire l’ECMO e la rimozione della CO2 sul posto, ma si è provveduto anche ad organizzare un servizio di trasporto in grado di garantire prestazioni elevatissime.
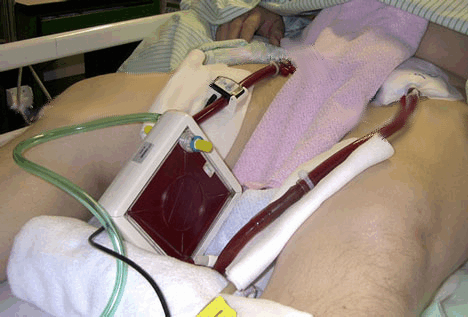
Interventional Lung Assist (iLA) Membrane Ventilator
Si tratta di una membrana eparinizzata della dimensione di 1,3 mq. racchiusa all’interno di un cubo in materiale plastico biocompatibile, in grado di rimuovere l’anidride carbonica sfruttando il gradiente di diffusione che si crea tra la CO2 ematica e l’ossigeno con cui la membrana viene perfusa. Il sistema non prevede l’utilizzo di pompe, di conseguenza sfrutta il circolo del paziente come forza propulsiva: da ciò si deduce che il suo impiego è riservato a soggetti che non soffrono di grave insufficienza cardiaca. L’iLA non rappresenta uno strumento in grado di correggere efficacemente problemi di ossigenazione. Infatti, a seguito del suo impianto, si assiste ad un aumento scarsamente significativo della PaO2, nell’ordine del 20%.
Al momento della connessione, si assiste ad una diminuizione della pressione arteriosa media pari a 7 mmHg (per un flusso ematico transmembrana pari a 1,5 l/min): l’eparinizzazione della membrana punta ad ottenere un PTT pari a 50-55 secondi. Non esistono in commercio membrane non eparinizzate: questo condiziona la possibilità di trattare pazienti con trombocitopenia indotta da eparina. Il flusso ematico all’interno del dispositivo viene misurato grazie ad un sensore di flusso ad ultrasuoni posto sulla linea venosa.
La rimozione extracorporea della CO2
Spesso -pur disponendo di ventilatori ad alte performances- non è possibile conseguire un livello di CO2 soddisfacente, né prima né durante il trasporto. Oltre all’ipercapnia permissiva, esistono situazioni dove il controllo della PaCO2 è mandatorio, come nel caso di pazienti con ipertensione endocranica o con gravissima acidosi respiratoria: in questi contesti specifici la normalizzazione della CO2deve avvenire nel minor tempo possibile.
La facilità con cui l’iLA può essere installato consente il suo utilizzo anche durante il trasporto secondario, garantendo un’adeguata rimozione della CO2.
L’uso dell’iLA può essere considerato anche in caso di trasporto aereo o in elicottero, in particolar modo quando i tempi di permanenza extraospedaliera aumentano.Rispetto all’ECMO, l’iLA appare di più facile impiego, di più rapido posizionamento e gravato da un minor numero di complicanze.
Indicazioni terapeutiche
La rimozione extracorporea della CO2 può essere applicata, con indicazioni ben precise, a numerose condizioni:
- Ipercapnia: come è noto, non sempre è possibile applicare il concetto di “ipercapnia permissiva”. In determinate categorie di pazienti, e in particolar modo per il paziente con pressione intracranica elevata, un’ipercapnia moderata può avere effetti deleteri sulla perfusione cerebrale. La coesistenza di patologie polmonari od extrapolmonari che condizionano l’aumento della PaCO2, rendono molto spesso necessaria una ventilazione aggressiva, che sacrifica pressioni e volumi per conseguire adeguati livelli di PaCO2. Inoltre, elevate pressioni intratoraciche generate da PEEP e volumi correnti aumentati, ostacolano il drenaggio venoso del circolo cerebrale. Esempi clinici sono rappresentati dalla polmonite, da stati febbrili, da Acute Lung Injury (ALI), ARDS primaria o secondaria.
- Ipercapnia resistente alla terapia ventilatoria: oltre a rappresentare un problema per pazienti con pressione intracranica elevata, l’ipercapnia può portare all’insorgenza di acidosi respiratoria. Con il termine “ipercapnia permissiva” viene indicato un livello di PaCO2 tale da non condizionare una diminuzione del pH inferiore a 7.20: nei pazienti che non rispondono alla terapia convenzionale o nelle situazioni dove non possono essere esercitate elevate pressioni/volumi polmonari, la rimozione esterna della CO2 consente di raggiungere livelli di pH adeguati.
- Elevate pressioni/volumi di esercizio in corso di ventilazione meccanica: una pressione di picco superiore a 35 cmH2O è correlata a maggior incidenza di lesioni polmonari barotraumatiche. In un lavoro proposto dal gruppo “The ARDS Network”, è stato dimostrato come una ventilazione protettiva con Pplat inferiore a 30 cmH2O (corrispondente ad un volume corrente di 6-4 ml/kg di peso) sia stata in grado di ridurre la mortalità dell’8,8% rispetto al gruppo di pazienti trattati con strategia ventilatoria tradizionale (Volume corrente o Tidal Volume [Vt] 12 ml/kg, Pplat < 50 cmH2O). I pazienti con fistola polmonare o con compliance ridotta, beneficiano di una ventilazione a bassi volumi e basse pressioni: in questo contesto, la rimozione esterna della CO2 consente l’adozione di strategie ventilatorie più protettive. Esempi clinici possono essere rappresentati da polmoniti, pneumotorace, fistole, BPCO, ALI, ARDS primaria o secondaria.
- Esaurimento muscolare: la rimozione extracoprorea dell’anidride carbonica è in grado di ridurre il lavoro muscolare dell’attività respiratoria. Tale effetto può essere ricercato nei casi in cui la ventilazione non invasiva risulti inefficace nella rimozione dell’anidride carbonica e non sia desiderabile o indicato intubare il paziente, nello svezzamento respiratorio in pazienti con miopatie o con polineuropatia da trattamento intensivo prolungato.
- Trapianto polmonare: in attesa di trapianto o nello svezzamento post-procedura.
Controindicazioni
Alcune controindicazioni limitano l’impiego del sistema iLA:
- Trombocitopenia indotta da eparina;
- In presenza di assetto emodinamicamente instabile, compromesso senza recupero dall’apertura dello shunt (shock cardiogeno, settico);
- Patologie vascolari degli arti inferiori;
- Peso corporeo inferiore a 20 kg.
Accessi vascolari
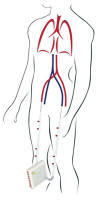
L’acquisizione della linea arteriosa femorale e della linea venosa femorale avviene grazie all’impianto di due cateteri vascolari, disponibili in varie dimensioni, che vengono posizionati con tecnica di Seldinger. Gli accessi vascolari sono costituiti da materiale biocompatibile che consente una curvatura del catetere pari a 180°. Le misure sono pari a 13-15 Fr x 9cm. di lunghezza per la cateterizzazione arteriosa e di 15-17 Fr x 14cm. di lunghezza per la cannulazione venosa. È consigliabile una valutazione ecografica del lume vascolare prima di avviare la procedura: al fine di evitare trombosi ed ischemia, il catetere non dovrebbe occupare più del 20% del diametro vascolare.
Gli approcci possibili sono rappresentati dalla cannulazione del vaso arterioso e di quello venoso dell’arto inferiore controlaterale, oppure dell’arteria e della vena femorale dello stesso arto. A causa della ridotta lunghezza dei tubi che raccordano il paziente all’iLA, non è possibile effettuare cateterismi in altri siti per ridurre al minimo le resistenze al flusso. Le caratteristiche meccaniche degli accessi vascolari consentono l’utilizzo del ventilatore a membrana anche con pazienti proni o in decubito laterale.
Priming del dispositivo
Il priming del dispositivo avviene utilizzando un apposito kit contenuto nella confezione del ventilatore. Le vie ed il ventilatore vengono riempiti con soluzione fisiologica (circa 270ml.), mentre l’operatore procede a debullare il circuito e la membrana. Al termine della procedura di priming l’apparecchio è pronto per l’impiego.
Connessione paziente
Eseguito il reperimento degli accessi vascolari ed il priming, il paziente può essere connesso alla membrana: il volume di sangue che viene assorbito per il funzionamento del ventilatore è di circa 240ml. Di conseguenza, specie in condizioni di labile compenso emodinamico, l’apertura della via arteriosa deve avvenire con cautela, per evitare ripercussioni sul circolo. A seconda delle condizioni emodinamiche del paziente, la procedura richiede più o meno tempo. Affinché la membrana funzioni correttamente, è necessario monitorare i tempi di coagulazione, che debbono essere compresi, riferendosi al PTT, fra 50-55 sec. Qualora l’eparinizzazione della membrana non fosse sufficiente a conseguire tale target, è possibile avviare un’infusione di eparina per via sistemica od utilizzare una tecnica di scoagulazione regionale connettendo l’infusione continua di eparina sulla via arteriosa e la protamina sulla via venosa. Durante tutta la terapia, il ventilatore deve rimanere ad una posizione declive rispetto agli accessi venosi.
Avviamento della terapia
La rimozione della CO2 deve avvenire in maniera graduale, per evitare ripercussioni sulla perfusione d’organo ed in particolare su quella cerebrale. La quantità di CO2 rimossa, per un flusso transmembrana costante, è direttamente proporzionale al flusso di ossigeno secco erogato. L’uso di flussimetri a passi di 0,5 l/min consente una più fine regolazione dei valori di CO2 rimossi.
Durata del dispositivo
In assenza di malfunzionamenti, il dispositivo può essere utilizzato ininterrottamente per un periodo di 30 giorni di terapia continua.
Sostituzione degli accessi venosi
Gli accessi venosi possono essere sostituiti con tecnica Seldinger in caso di infezione correlata al catetere. La variazione del luogo di venipuntura sullo stesso arto può essere problematica, in considerazione del grosso calibro degli accessi e della loro lunghezza. In tal senso, sembrerebbe quindi raccomandabile utilizzare l’approccio veno-arterioso omolaterale: in questo modo l’arto controlaterale può essere utilizzato successivamente per una nuova venipuntura.
Rianimazione cardiopolmonare
Durante la rianimazione cardiopolmonare è necessario clampare immediatamente gli accessi venosi del dispositivo.
Gestione della terapia
Instaurato il flusso sanguigno, è necessario procedere alla connessione della fonte di ossigeno per avviare la rimozione della CO2. La necessità di iniziare con bassi flussi è imposta dal fatto che brusche variazioni della CO2 possono produrre alterazioni della perfusione d’organo, con particolare riferimento alla perfusione cerebrale.
Il passaggio ad un flusso più consistente deve avvenire solo previa verifica, tramite emogasanalisi, dei risultati ottenuti. L’incremento del flusso dovrebbe avvenire con intervalli di tempo non inferiori a 10 minuti.
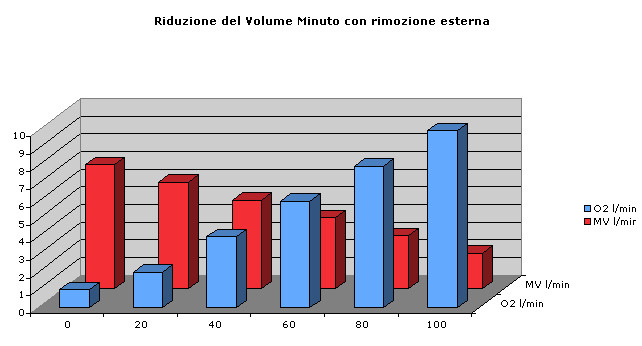 Nella ventilazione protettiva, l’aumento del flusso di ossigeno trans membrana, e quindi della rimozione della CO2, dovrebbe corrispondere ad una progressiva diminuzione del Vt e delle pressioni respiratorie.
Nella ventilazione protettiva, l’aumento del flusso di ossigeno trans membrana, e quindi della rimozione della CO2, dovrebbe corrispondere ad una progressiva diminuzione del Vt e delle pressioni respiratorie.
La letteratura
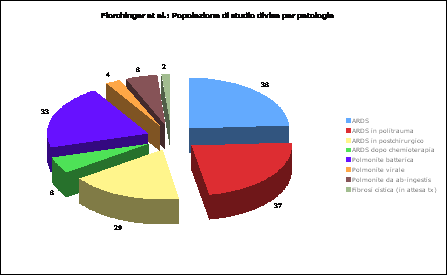 Due studi appaiono particolarmente meritevoli di menzione circa l’applicazione della pECLA (pumpless extracorporeal lung assist) con dispositivo iLA.
Due studi appaiono particolarmente meritevoli di menzione circa l’applicazione della pECLA (pumpless extracorporeal lung assist) con dispositivo iLA.
Il lavoro di Bein (retrospettivo), analizza l’uso della pECLA in 90 pazienti affetti da ARDS, con l’obiettivo di valutarne l’efficacia in termini di rimozione della CO2. Nello studio, dove sono sopravvissuti 37 pazienti, la normalizzazione della CO2 è stata conseguita a due ore dall’inizio della terapia (PaCO2 iniziale: min. 48 max. 80 mean 60 mmHg, PaCO2 a 2 ore dall’inizio del trattamento: min. 30 max. 44 min. mean 36 mmHg). In questo lavoro sono state osservate complicanze nel 24,4% dei casi, la maggior parte delle quali rappresentate da ischemia degli arti inferiori. Tali risultati sono stati recentemente suffragati dall’opera di Muller et coll. Lo studio retrospettivo di Florchinger et al. descrive l’esperienza decennale del proprio gruppo di lavoro circa l’uso dell’iLA. In 10 anni sono stati trattati 159 pazienti. Altri lavori hanno analizzato la mortalità in gruppi omogenei di pazienti comparando la pECLA all’ECMO. Il contributo di Liebold et coll. appare particolarmente rappresentativo da questo punto di vista: nel pur ristretto ma estremamente omogeneo gruppo di pazienti arruolati per questo studio, la mortalità risulta essere sovrapponibile a quella dei pazienti trattati con ECMO. Nello studio di Florchinger et al. (prospettico) sono stati arruolati 159 pazienti (divisione per patologia nel grafico a lato). Sono stati inoltre registrati i parametri emogasanalitici, emodinamici (MAP, Cardiac Output, Lattati, nordadrenalina mg/h), il tempo di protrombina, le piastrine, i leucociti, l’emoglobina, la creatinina e la bilirubina prima dell’istituzione della terapia, a 2 e 24 ore dall’inizio della terapia, prima della disconnessione dall’iLA e a 24 ore dal termine della terapia (vedi tabella 2 a pagina successiva).
I risultati hanno dimostrato:
a) la riduzione in ordine del 40% dei valori di PaCO2 a due ore dall’inizio della terapia;
b) la normalizzazione del pH a due ore dall’avvio del pECLA;
c) una costante diminuzione delle pressioni di picco e del Vt;
d) la necessità di un minor dosaggio di noradrenalina a partire dalle 24 ore dopo l’avvio della terapia.
In questo gruppo, vennero estubati con successo il 52,2% dei pazienti. La mortalità fu del 47,8%, suddivisa come segue: 50 pazienti decedettero per insufficienza multiorgano, 38 per shock settico e 13 per insufficienza cardiaca. Gli effetti collaterali furono rappresentati da: 13 casi di ischemia agli arti inferiori: di questi, in 4 casi fu necessario ricorrere a fasciotomie, mentre in un caso il paziente subì l’amputazione dell’arto inferiore.
Tabella 2 – Parametri clinici dopo applicazione di pECLA (Florchinger et coll.)
| Pre-pECLA | A 2 ore | A 24 ore | Allo stop | A 24 ore da stop | |
|---|---|---|---|---|---|
| FiO2 | 96 | 89 | 77 | 48 | 50 |
| PaO2 | 66 | 81 | 79 | 91 | 96 |
| PaO2/FiO2 | 72 | 95 | 111 | 203 | 202 |
| PaCO2 | 67 | 40 | 35 | 39 | 48 |
| SaO2% | 86 | 93 | 95 | 96 | 96 |
| pH | 7,25 | 7,4 | 7,44 | 7,43 | 7,38 |
| Respiratory rate (b/min) | 32 | 30 | 29 | 21 | 23 |
| Ppeak (cmH2O) | 37,7 | 36 | 34,5 | 29,6 | 30 |
| PEEP Media (cmH2O) | 15 | 15 | 14 | 12 | 11 |
| Vt (ml) | 453 | 404 | 402 | 450 | 497 |
| MAP (mmHg) | 74 | 87 | 89 | 84 | 80 |
| CO (lt/min) | 8,7 | 9,7 | 9,3 | 8,5 | 6,8 |
| Noradrenalina (mg/h) | 2 | 2 | 1,3 | 0,6 | 0,5 |
| Lattati (mg/dl) | 37 | 59 | 46 | 23 | 28 |
| Creatinina | 1,7 | 2 | 1,6 | 1,3 | 1,4 |
Venne inoltre confermato come il flusso trans-membrana sia direttamente proporzionale alla rimozione della CO2.
Dalla letteratura si evince come la rimozione extracorporea della CO2 sia stata applicata, nella maggior parte dei casi, in pazienti sottoposti a ventilazione meccanica per gravi patologie polmonari, mentre la sua applicazione in altri casi non trova ampio riscontro nella bibliografia attualmente disponibile, dove esistono solo alcuni case-report.
Conclusioni
- La centralizzazione di pazienti con ARDS/ALI refrattaria alle terapie convenzionali dovrebbe essere precoce e strutturata;
- Il trasporto di tali pazienti dovrebbe avvenire ad opera di appositi team adeguatamente equipaggiati e formati;
- In casi selezionati, l’avvio dell’ECMO o della rimozione della CO2 extracorporea dovrebbe essere avviata sul posto, prima del trasferimento;
- Il sistema iLA si è dimostrato efficace, di facile applicazione e gestibile anche durante il trasporto secondario.
Bibliografia
Amato MB et al. “Effect of a Protective-Ventilation Strategy on Mortality in the Acute Respiratory Distress Syndrome” New Eng J of Med, 1998;338:347-354
Bein T. “Pumpless extracorporeal lung assist (pECLA) in patients with acute respiratory distress syndrome and severe brain injury” J Trauma, 2005;58:1294-1297
Bein T., Weber F., Philipp A. “A new pumpless extracorporeal interventional lung assist in critical hypoxiemia/hypercapnia” Crit Care Med, 2006;34:1372-1377
Bellingan G, Olivier T, Batson S, Webb A “Comparison of a specialist retrieval team with current UK practice for the transport of critically ill patients” Int Care Med, 2000;26:740-744
Elliot SC. “Pumpless extracorporeal carbon dioxide removal for life threatening asma” Crit Care Med, 2007;35(3):945-948
Florchinger B., Philipp A., Klose A., et al. “Pumpless extracorporeal lung assist: a 10 year institutional experience” Ann Thorac Surg, 2008;86:410-417
Goss CH, Brower RG, Hudson LD et al “Incidence of acute lung injury in the United States” Crit Care Med, 2003;31:1607-1611
Kolobow T, Gattinoni L, Tomlinson TA et al “Control of breathing using an extracorporeal membrane lung” Anesthesiology, 1977;46:138-141
Liebold A., Reng CN., Philipp A. “Pumpless extracorporeal lung assist experience with first twenty case” Eur J Cardiothorac Surg, 2000;30:38-41
Marx G, Vangerow B, Hecker H, Leuwer M “Predictors of respiratory function deterioration after transfer of critically ill patients” Int Care Med, 1998;24:1157-1162
Muller T., Lubnow M., Philipp A., Bein T. et al “Extracorporeal pumpless interventional lung assist in clinical practitce: determinants of efficacy” Eur Respir J, 2008 – Published on-line bifore print Novembre 14, 2008 @ https://erj.ersjournal.com
Rubenfeld GD, Herridge MS “Epidemiology and outcomes of acute lung injury” Chest, 2007;131:554-562
Tao W., Brunston RL., Bidani A., Pirtle P, Dy J., Cardenas VJ, Traber DL, Zwischenberger JB “Significant reduction in minute ventilation and peak inspiratory pressures with arteriovenous CO2 removal during severe respiratory failure” Crit Care Med, 1997;25(4):689-695
The ARDS Group “Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome” The New Eng J of Medicine, 2000;342(16)-Editorial.
Villa GF, Raimondi M in Torri G, Calderini E “Tecniche di ventilazione artificiale” – Edizioni Fogliazza, Milano, 2000 – PP 285-286
Waydhas C. “Intrahospital transport of critically ill patients” Crit Care, 1999;3:R83-R89
Zimmermann M. “From Baghdad to Germany: use of a new pumpless extracorporeal lung assist in two severely injured US soldiers” ASAIO, 2007;53(3):4-6
Zimmermann M. et al “Interhospital transportation of patient with severe lung failure on pumpless extracorporeal lung assist” British J Anaesth, 2005;96(1):63-66
Zwischenberger J., Conrad S., Alpard S., Grier R., Bidani A. “Pecutenaeous extracorporeal arteriovenous CO2 removal for severe respiratory failure” The Annals of Thoracic Surgery, 1999;68:181-187
Kolobow T, Gattinoni L, Tomlinson TA et al “Control of breathing using an extracorporeal membrane lung” Anesthesiology, 1977;46:138-141
Goss CH, Brower RG, Hudson LD et al “Incidence of acute lung injury in the United States” Crit Care Med, 2003;31:1607-1611
Rubenfeld GD, Herridge MS “Epidemiology and outcomes of acute lung injury” Chest, 2007;131:554-562
Waydhas C. “Intrahospital transport of critically ill patients” Crit Care, 1999;3:R83-R89
Marx G, Vangerow B, Hecker H, Leuwer M “Predictors of respiratory function deterioration after transfer of critically ill patients” Int Care Med, 1998;24:1157-1162
Villa GF, Raimondi M in Torri G, Calderini E “Tecniche di ventilazione artificiale” – Edizioni Fogliazza, Milano, 2000 – PP 285-286
Amato MB et al. “Effect of a Protective-Ventilation Strategy on Mortality in the Acute Respiratory Distress Syndrome” New Eng J of Med, 1998;338:347-354
Bellingan G, Olivier T, Batson S, Webb A “Comparison of a specialist retrieval team with current UK practice for the transport of critically ill patients” Int Care Med, 2000;26:740-744
Bein T. “Pumpless extracorporeal lung assist (pECLA) in patients with acute respiratory distress syndrome and severe brain injury” J Trauma, 2005;58:1294-1297
The ARDS Group “Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome” The New Eng J of Medicine, 2000;342(16)-Editorial.
Zwischenberger J., Conrad S., Alpard S., Grier R., Bidani A. “Pecutenaeous extracorporeal arteriovenous CO2 removal for severe respiratory failure” The Annals of Thoracic Surgery, 1999;68:181-187
Tao W., Brunston RL., Bidani A., Pirtle P, Dy J., Cardenas VJ, Traber DL, Zwischenberger JB “Significant reduction in minute ventilation and peak inspiratory pressures with arteriovenous CO2 removal during severe respiratory failure” Crit Care Med, 1997;25(4):689-695
Bein T., Weber F., Philipp A. “A new pumpless extracorporeal interventional lung assist in critical hypoxiemia/hypercapnia” Crit Care Med, 2006;34:1372-1377
Florchinger B., Philipp A., Klose A., et al. “Pumpless extracorporeal lung assist: a 10 year institutional experience” Ann Thorac Surg, 2008;86:410-417
Muller T., Lubnow M., Philipp A., Bein T. et al “Extracorporeal pumpless interventional lung assist in clinical practitce: determinants of efficacy” Eur Respir J, 2008 – Published on-line bifore print Novembre 14, 2008 @ https://erj.ersjournal.com
Liebold A., Reng CN., Philipp A. “Pumpless extracorporeal lung assist experience with first twenty case” Eur J Cardiothorac Surg, 2000;30:38-41
Elliot SC. “Pumpless extracorporeal carbon dioxide removal for life threatening asma” Crit Care Med, 2007;35(3):945-948
Zimmermann M. “From Baghdad to Germany: use of a new pumpless extracorporeal lung assist in two severely injured US soldiers” ASAIO, 2007;53(3):4-6
Zimmermann M. et al “Interhospital transportation of patient with severe lung failure on pumpless extracorporeal lung assist” British J Anaesth, 2005;96(1):63-66