Autori
Federico Emiliano Ghio (Infermiere Busnago Soccorso)
Simone Della Torre (Soccorritore-Istruttore Busnago Soccorso)
Criteri diagnostici per l’ARDS
Questa sindrome ha ricevuto negli anni diverse definizioni: polmone umido, polmone da shock, edema polmonare da lesione capillare. Tra le diverse denominazioni, si è imposto negli anni il termine “Acute Respiratory Distress Syndrome”. L’ARDS interessa sia pazienti pediatrici che in età adulta.
Nella classificazione proposta dall’American European Consensus Conference on ARDS nel 2000, la diagnosi viene posta secondo i seguenti criteri:
- Insorgenza acuta
- PaO2/FiO2 < 200 indipendentemente dal livello di PEEP
- Infiltrati polmonari bilaterali (dopo 12-24 ore)
- Compliance < 30 ml/cm H2O
- PCWP < 18 mmHg
- Evocata da “evento catastrofico” (trauma, chirurgia, ecc.)
L’ARDS non rappresenta una malattia a primitivismo polmonare, ma una complicanza che ha luogo quando altri stati patologici generano una forma severa e progressiva di risposta infiammatoria sistemica. Il processo infiammatorio coinvolge i polmoni, condizionando l’accumulo -fino all’obliterazione- di eritrociti, leucociti e frammenti proteinacei all’interno degli spazi aerei alveolari. Si ritiene che il consolidamento polmonare sia determinato da un’attivazione sistemica dei neutrofili circolanti: questi aderiscono all’endotelio vascolare nei capillari polmonari e rilasciano poi il contenuto dei loro granuli citoplasmatici (enzimi proteolitici e metaboliti tossici dell’ossigeno) causando danno endoteliale con conseguente essudazione di natura lesionale all’interno dei capillari del parenchima polmonare. I neutrofili ed altri mediatori dell’infiammazione possono quindi accedere al parenchima polmonare e proseguire il processo infiammatorio.
Il quadro clinico dell’ARDS è caratterizzato da una grave condizione di infiammazione polmonare, condizionante ipossiemia nonostante l’utilizzo di elevate percentuali di FiO2. A ciò si associa un’alterazione del rapporto ventilazione/perfusione secondario ad uno shunt polmonare destro-sinistro. La diminuzione della compliance polmonare è dovuta all’accumulo di fluidi extravascolari.
L’ipercapnia e l’ipertensione polmonare complicano spesso sia l’ARDS che l’ALI. I fattori predisponenti allo sviluppo di ARDS sono rappresentati da politrauma, sepsi, ab-ingestis, ustioni, polmoniti, intossicazioni. La diagnosi differenziale viene posta con l’edema polmonare cardiogeno (pressione di incuneamento polmonare > 18 mmHg) e l’Acute Lung Injury (ALI).
Per quanto attiene la diagnosi di ALI -Acute Lung Injury-, la stessa viene posta in presenza di:
- Insorgenza acuta
- PaO2/FiO2 < 300
- Infiltrati polmonari bilaterali (dopo 12-24 ore)
- Compliance < 30 ml/cm H2O
- PCWP < 18 mmHg
- Evocata da “evento catastrofico” (trauma, chirurgia, ecc.)
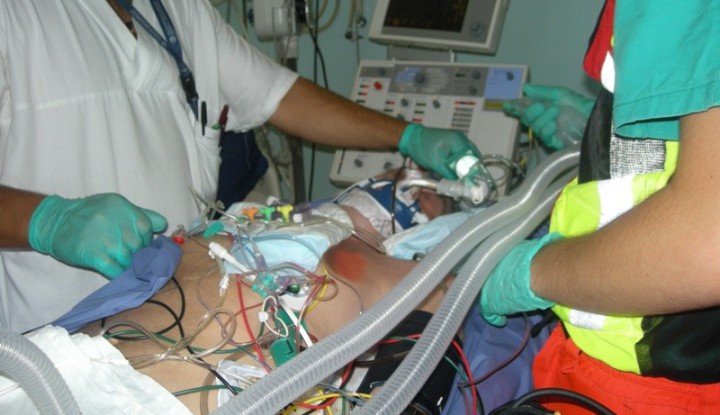
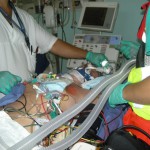
Il trasporto del paziente con ALI/ARDS
I semplici ventilatori volumetrici -normalmente impiegati sui mezzi di soccorso- non sono in grado di garantire una gestione sicura dei soggetti affetti da ALI/ARDS. Senza dubbio, la possibilità di disporre di un ventilatore da terapia intensiva, a bordo dell’Unità Mobile di Rianimazione o dell’eliambulanza/aeroambulanza, rappresenta il gold-standard per il trattamento di questi pazienti. Il limite di tali strumenti è rappresentato dagli elevati costi di acquisto, dalle dimensioni e dall’impossibilità – nella maggior parte dei casi- di disporre di carrelli e/o sistemi di ritenuta omologati che mettano al riparo l’operatore non solo da problematiche di tipo clinico logistico ma anche di natura medico-legale. Occorre del resto sottolineare che durante il trasporto non possono essere adottate tecniche speciali come la pronazione e la ventilazione con ossido nitrico.
Il cambio del ventilatore rappresenta uno dei momenti più difficili del trasporto: la possibilità che il paziente si disadatti, la perdita della PEEP e la diversa risposta del ventilatore al paziente (anche a parità di strategia ventilatoria) esitano spesso nel deterioramento degli scambi respiratori ed in un aumentato rischio di complicanze e mortalità. Secondo Villa et al. nel testo “Tecniche di ventilazione artificiale” [1] è prevista la possibilità di connettere il paziente al ventilatore, utilizzato per un tempo ragionevole prima dell’inizio del trasferimento, verificando con emogasanalisi seriate ed esami radiografici l’efficacia della terapia impostata. Tuttavia, ancora troppo spesso, tale approccio non viene o non può essere adottato con la conseguente predisposizione ad eventi avversi durante il viaggio.
La mancata disponibilità di ventilatori da terapia intensiva impone di accettare un mediocre controllo degli scambi adottando modalità ventilatorie che si configurano ben al di fuori del concetto di ventilazione protettiva, introdotto da Amato et al. nel 1998 [2]; non solo, spesso, tale approccio fallisce generando aggravi delle condizioni cliniche.
In ultimo è stato dimostrato come il trasporto di questi pazienti da parte di personale non specificamente addestrato si traduca in un outcome sfavorevole [3].
L’intervento di un equipe specialistica in grado di avviare l’ECMO o la pECLA al luogo di partenza, dovrebbe essere presa in considerazione quando l’approccio standard fallisce ed il paziente versa in condizioni di grave instabilità cardiorespiratoria.
L’assistenza clinica durante il trasporto deve essere assicurata tramite una corretta dotazione strumentale ed un equipe specificatamente addestrata alla gestione di questi pazienti.
Per quanto concerne l’aspetto ventilatorio, giova ricordare che la perdita della PEEP può essere evitata serrando il tubo con una pinza retta mentre il paziente viene connesso al ventilatore da trasporto. Un sistema di aspirazione delle secrezioni a circuito chiuso impedirà ulteriori perdite di pressione. Il problema dell’auto-trigger è frequente quando vengono utilizzate modalità di ventilazione assistite (BIPAP) con valori di trigger a flusso particolarmente bassi (da 1 a 3 l/min). L’attivazione automatica del trigger è generalmente dovuta all’oscillazione del circuito ventilatorio, meno frequente alle vibrazioni prodotte dall’elicottero o da un ambulanza su fondo stradale in buone condizioni. Rendere il circuito stabile (evitando di sospenderlo tra paziente e ventilatore e facendolo decorrere a lato del paziente o sul torace dello stesso) consentono l’utilizzo di un trigger adeguato al paziente senza complicazioni: quando tale provvedimento non risulta sufficiente, è possibile innalzare la soglia del trigger di 1 l/min e verificare il risultato. Il circuito del ventilatore deve essere sterile per prevenire l’insorgenza di VAP (Ventilator Associated Pneumoniae).
Il monitoraggio deve comprendere: ECG, pressione arteriosa cruenta, pressione arteriosa non cruenta (da utilizzare come back-up), EtCO2, SpO2%. In caso sia presente un catetere di Swan-Ganz, questo deve essere retratto in prossimità dell’atrio destro, istituito il monitoraggio dell’onda ed opportunamente fissato per impedirne la dislocazione durante il trasporto. La temperatura vescicale o esofagea deve essere monitorizzata in continuo, specialmente quando vengono intraprese metodiche di ossigenazione/rimozione CO2 extracorporee. Gli accessi vascolari per l’ECMO o l’iLA devono essere prontamente accessibili: durante l’utilizzo dell’iLA deve essere prevista la presenza di due pinze rette in materiale plastico per clampare il sistema in caso di arresto cardiaco o grave ipotensione.
Il presidio più indicato per il trasporto sembra essere il materasso a depressione, che garantisce miglior confort al paziente e maggiore assorbimento delle vibrazioni. La possibilità di ottenere dati emogasanalitici durante il trasporto deve essere considerata per pazienti particolarmente compromessi o per viaggi di durata superiore alla mezz’ora. Un centro mobile di rianimazione di back-up deve seguire la prima ambulanza quando si prevede il trasporto di pazienti particolarmente instabili. Invariate le già note raccomandazioni in termini di disponibilità di alimentazione elettrica, batterie di scorta, gas medicali, ecc.
Centralizzazione
I pazienti con ALI/ARDS, che non rispondono alla terapia standard, dovrebbero essere avviati a centri ad alta specializzazione in grado di istituire terapie come l’ossigenazione extracorporea. Ad oggi in Italia non esiste un network relativo alla gestione dei pazienti affetti da ARDS/ALI refrattaria, con conseguenti ritardi ed outcome sfavorevoli dovuti all’assenza di una corretta centralizzazione basata su criteri specifici.
Bibliografia:
[1] Villa GF, Raimondi M in Torri G, Calderini E “Tecniche di ventilazione artificiale” – Edizioni Fogliazza, Milano, 2000 – PP 285-286
[2] Amato MB et al. “Effect of a Protective-Ventilation Strategy on Mortality in the Acute Respiratory Distress Syndrome” New Eng J of Med, 1998;338:347-354
[3] Bellingan G, Olivier T, Batson S, Webb A “Comparison of a specialist retrieval team with current UK practice for the transport of critically ill patients” Int Care Med, 2000;26:740-744